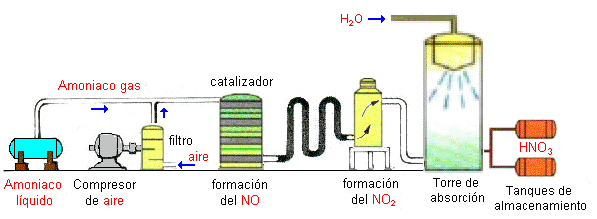
Carbonatacion: es un tipo de disolucion en la que interviene
Número de Avogadro
Cifra numérica muy utilizada en química para medir la cantidad de átomos presente en un mol de átomos, o de moléculas en un mol de moléculas cuyo valor exacto es de 6'023x10^23. Luego, su función es representar un mol de cualquier sustancia.
Catalizador
Sustancia química que se utiliza para modificar la velocidad de una reacción química, ya sea para acelerar o ralentizar, específico para cada reacción y que se recupera finalizada esta.
Superficie de catalizador, al entrar en contacto con los reactivos.
Sistema Termodinámico
Un sistema termodinámico es una parte del universo que se separa de su entorno (lo que rodea al sistema) para estudiarlo u observarlo mediante una especie de "barrera" o "pared", que puede ser real o imaginaria (no se puede ver).

http://www.tideca.net/sites/default/files/sistema_termodinamico_f.png
Un ejemplo de sistema termodinámico seria un recipiente en el que tiene lugar una reacción química o una hoguera, donde podemos ver una reacción de combustión.

http://www.quimitube.com/wp-content/uploads/2013/04/separacion-sistema-entorno.png
Estos sistemas pueden intercambiar o no materia y energía con su entorno, de esta forma podemos clasificarlos en: abiertos (intercambian ambas), cerrados (intercambian energía) y aislados (no intercambian ninguna).

http://www.tideca.net/sites/default/files/sistema_termodinamico_f.png
Un ejemplo de sistema termodinámico seria un recipiente en el que tiene lugar una reacción química o una hoguera, donde podemos ver una reacción de combustión.

http://www.quimitube.com/wp-content/uploads/2013/04/separacion-sistema-entorno.png
Estos sistemas pueden intercambiar o no materia y energía con su entorno, de esta forma podemos clasificarlos en: abiertos (intercambian ambas), cerrados (intercambian energía) y aislados (no intercambian ninguna).
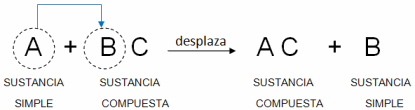
Reacción de Doble Sustitución
Una reacción de doble sustitución es aquella en la que dos elementos que se encuentran formando parte de diferentes compuestos intercambian sus posiciones, formando sustancias completamente diferentes.
AB + CD --> CB + AD
Esta misma reacción la podemos ver en nuestro día a día, por ejemplo:
A ti y a tu amigo os dan dos sándwiches, sin embargo a ninguno de los dos os gusta el que os ha tocado por lo que os los intercambiáis. En este caso los sándwiches son los que intercambian sus posiciones (A y C en el esquema anterior).
Otro ejemplo seria un baile por parejas si cuando pase un tiempo, un miembro de la pareja se intercambia por uno de los miembros de otra pareja.
http://image.slidesharecdn.com/reaccionesquimicas-111006212343-phpapp01/95/quimica-reacciones-quimicas-24-728.jpg?cb=1317936285
AB + CD --> CB + AD
Esta misma reacción la podemos ver en nuestro día a día, por ejemplo:
A ti y a tu amigo os dan dos sándwiches, sin embargo a ninguno de los dos os gusta el que os ha tocado por lo que os los intercambiáis. En este caso los sándwiches son los que intercambian sus posiciones (A y C en el esquema anterior).
Otro ejemplo seria un baile por parejas si cuando pase un tiempo, un miembro de la pareja se intercambia por uno de los miembros de otra pareja.

http://image.slidesharecdn.com/reaccionesquimicas-111006212343-phpapp01/95/quimica-reacciones-quimicas-24-728.jpg?cb=1317936285
Reactivo Limitante
El reactivo limitante en una reacción química es aquella sustancia que reacciona completamente para dar un determinado producto. Una vez que el reactivo se agota, la reacción deja de producirse y no se puede obtener mas producto.
TODOS los cálculos estequiométricos deben realizarse con este reactivo. Ejemplo:

https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgNFgMxAmnHvp8v-iJffllTc92Enyvh955T9WXq7Zm6OHQIRDmNROTUd2usCGWFZUNdPRsV2SOMCw_kw8-fZzUpL3j-qjLdDr_qi2CGeaJ6J43jSIxIIco0OGHmcBfwy-RrbMfivdT0BbIQ/s1600/estequiometria12.jpg
En este caso, el reactivo limitante es el queso ya que, aunque tengamos pan suficiente, una vez que las lonchas de queso se agotan no podemos hacer mas sándwiches (producto). De esta forma la relación entre ambos para que se obtenga producto es 1-1.
TODOS los cálculos estequiométricos deben realizarse con este reactivo. Ejemplo:

https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgNFgMxAmnHvp8v-iJffllTc92Enyvh955T9WXq7Zm6OHQIRDmNROTUd2usCGWFZUNdPRsV2SOMCw_kw8-fZzUpL3j-qjLdDr_qi2CGeaJ6J43jSIxIIco0OGHmcBfwy-RrbMfivdT0BbIQ/s1600/estequiometria12.jpg
En este caso, el reactivo limitante es el queso ya que, aunque tengamos pan suficiente, una vez que las lonchas de queso se agotan no podemos hacer mas sándwiches (producto). De esta forma la relación entre ambos para que se obtenga producto es 1-1.
ALTO HORNO
Un alto horno es una construcción en forma de cuba de acero, de unos 60 metros, que introduciendo el mineral se convierten en hierro fundido. El alto horno es necesaria para la siderurgia.
Sistema abierto
La mayoría de los sistemas que nos rodean son abiertos, por ejemplo:
- Una olla con agua hirviendo: intercambia energía con el entorno y transfiere materia (vapor) al ambiente.
http://www.cronica.com.ar/tag/index/6613/agua-hirviendo
- Vehículo: intercambia materia con el exterior cuando se carga, cuando el conductor se introduce en su interior para conducirlo...
- La combustión de madera: desprende gases, humo , calor..
http://www.clubtabascozacatecas.com/profiles/blogs/humo-sobre-mi-rostro
Reacción de descomposición
Es una reacción en la cual, a partir de una sustancia compuesta (formada por dos o más compuestos), se forman dos o más sustancias con una estructura más simple.
AB → A + B
Esta separación puede estar causada de forma espontánea o por agentes externos como el calor, la electricidad, la humedad, las radiaciones...
Por ejemplo: el agua, que puede descomponerse en hidrógeno y oxígeno por medio de una corriente eléctrica.
https://es.wikipedia.org/wiki/Descomposici%C3%B3n_qu%C3%ADmica#/media/File:Chemical_decomposition.gif
AB → A + B
Esta separación puede estar causada de forma espontánea o por agentes externos como el calor, la electricidad, la humedad, las radiaciones...
Por ejemplo: el agua, que puede descomponerse en hidrógeno y oxígeno por medio de una corriente eléctrica.
Corriente eléctrica
2H2O (l) → 2H2(g) + O2 (g)
https://es.wikipedia.org/wiki/Descomposici%C3%B3n_qu%C3%ADmica#/media/File:Chemical_decomposition.gif
Coloide
Es una mezcla con dos fases: una fluida con partículas líquida y otra dispersa con partículas sólidas, y no se separan cuando están en reposo.
Las partículas sólidas son insolubles en agua (micelas) a veces son transparentes/presentan un aspecto turbio y pueden dispersar la luz. A este fenómeno se le llama efecto Tyndall.
Por ejemplo: la niebla, que está formada por la dispersión de gotitas en el aire y cuando la luz de los faros la atraviesa, se ensancha por la dispersión que esta experimenta por el efecto tyndall, lo mismo ocurre con el polvo en el aire o la gelatina.
http://es.dreamstime.com/metrajes-camino-de-niebla-hd-del-coche-de-la-niebla-de-la-noche-video50055960
http://quimicayuliana.blogspot.com.es/2011/08/ejemplos-de-elemento-mezcla-compuesto.html
Las partículas sólidas son insolubles en agua (micelas) a veces son transparentes/presentan un aspecto turbio y pueden dispersar la luz. A este fenómeno se le llama efecto Tyndall.
Por ejemplo: la niebla, que está formada por la dispersión de gotitas en el aire y cuando la luz de los faros la atraviesa, se ensancha por la dispersión que esta experimenta por el efecto tyndall, lo mismo ocurre con el polvo en el aire o la gelatina.
http://es.dreamstime.com/metrajes-camino-de-niebla-hd-del-coche-de-la-niebla-de-la-noche-video50055960
http://quimicayuliana.blogspot.com.es/2011/08/ejemplos-de-elemento-mezcla-compuesto.html
Espectroscopia Infrarroja
Es un tipo de espectroscopia que se encarga de caracterizar a las moléculas. En ella se busca la manera determinada de hacer vibrar a los enlaces que las forman. Se enfoca a la molécula con luz infrarroja y, si estas reciben una radiación CON LA MISMA FRECUENCIA que la vibración natural de sus enlaces, dicha radiación es absorbida. Analizando la energía que se ha absorbido es posible reconocer los diferentes tipos de enlaces (covalentes) presentes, y finalmente, identificar la molécula.
Esquema sencillo del proceso:
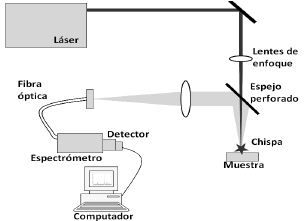
Esquema sencillo del proceso:

Soluto
El soluto es toda aquella sustancia que esta disuelta en otra; llamada disolvente. Dependiendo de su cantidad o su proporción con el disolvente, se distinguen 3 tipos de disolución: diluida, concentrada y saturada. Dicha cantidad de soluto en una disolución la mide la concentración (que puede ser de diversos tipos - molar, molal, ...) y todas ellas dependen de la masa atómica/molecular del soluto, la cual distingue cada sustancia atribuyéndoles una cantidad determinada que las caracteriza (Por ejemplo, el H2O tiene de masa molecular: 18g/mol y el MgSO4 tiene 120,3 g/mol por lo que son compuestos totalmente distintos). Además, las características de cada soluto influirán en su solubilidad y también determinarán si se formará precipitado (si no tenemos en cuenta presión y temperatura).


Entropía
La entropía es una medida o magnitud que nos informa sobre el grado de desorden de las partículas en la materia. Ésta se representa con la letra S y suele ser mayor en las sustancias que se encuentran en estado gaseoso. La entropía estandar o Sº es aquella medida a 1 atm y 25ºC. Se dice que hay un aumento de entropía cuando su incremento es mayor que 0, y es un descenso cuando su incremento está por debajo de 0. En reacciones químicas, la variación de ésta se conoce calculando la diferencia entre la entropía de productos y reactivos.
Enrasar
Enrasar es un proceso que se lleva a cabo a la hora de preparar una disolución; y consiste en añadir agua a la disolución en un matraz aforado de forma muy cuidadosa hasta igualar el nivel y el volumen deseado. Se suele realizar con un cuentagotas para no pasarnos ni quedarnos cortos y siempre debemos medir por debajo del menisco.
Rendimiento de una reacción
Las cantidades teóricas en una reacción, son las cantidades de producto que se obtienen si reacciona todo el reactivo limitante.
Las cantidades reales en una reacción, son las cantidades de prodcuto que se obtienen en la realidad, sabiendo que no reacciona todo el reactivo limitante.
Con esto se establece el rendimiento de una reacción química a través de un porcentaje que es:
Las cantidades reales en una reacción, son las cantidades de prodcuto que se obtienen en la realidad, sabiendo que no reacciona todo el reactivo limitante.
Con esto se establece el rendimiento de una reacción química a través de un porcentaje que es:
 |
| http://aprendequimica.blogspot.com.es/ |
Mezcla homogénea
Una mezcla homogénea es aquella en la cual el tamaño de las partículas de la fase dispersa (soluto), que se encuentra en menor proporción, es tan pequeño que no se puede apreciar a simple vista. Este tamaño es menor de 1nm.
Presentan las mismas propiedades y composición en toda su extensión, y en el caso de líquidos se llaman disoluciones; por ejemplo, el vaso de leche con colacao que tomamos por las mañanas, el cloro de la piscina o el tinte disueltos en agua...
 |
| http://rubensh.empowernetwork.com/blog/clasificacion-de-la-materia-mezclas-sustancias-elementos-compuestos-coloides-y-soluciones |
Ley de Henry
Esta ley dice que la solubilidad de un gas en un líquido sometida a una temperatura constante es directamente proporcional a la presión parcial del gas. Es decir, al aumentar la presión de un gas en un líquido aumenta la solubilidad.
Un ejemplo se da cuando nos encontramos buceando. La presión existente debida a la profundidad aumenta la solubilidad en la sangre del nitrógeno respirado por los buzos. Por lo tanto, si ascienden muy deprisa la presión se va normalizando con la superficie y el nitrógeno es cada vez menos soluble por lo que da lugar a unas burbujas peligrosas en la sangre de los buceadores que puede acabar en la muerte.
 |
| http://ocw.uc3m.es/ciencia-e-oin/quimica-de-los-materiales/Material-de-clase/tema-4.-solidos-liquidos-y-disoluciones-ii/skinless_view |
Molaridad
La molaridad o también llamada concentración molar es el número de moles de soluto que se encuentran disueltos en un dicho volumen. Su unidad: mol/L (Litro). Su formula:
Molaridad (M) =
| n (nº de moles de soluto) |
·
|
| Volumen de disolución |
 |
| https://sites.google.com/site/portafoliodeevidenciaslee/molaridad |
Efecto Tyndall
Se trata de un fenómeno físico en el que explica como las partículas coloidales (tipo de mezcla de apariencia homogénea, transparente) en una disolución o un gas son visibles porque reflejan la luz. Estas partículas a primera vista no son visibles pero tienen la capacidad de absorber la luz de manera diferente al medio, es decir, permite distinguirlas a simple vista al dispersar la luz. Esto permite distinguirlas de las mezclas homogéneas, que son también transparentes pero no tienen esta capacidad de dispersar la luz.
Ejemplo: Cuando entra luz solar en nuestra habitación podemos ver el polvo en suspensión, esto es porque son partículas coloidales, como se puede ver en la imagen de arriba.
 |
| http://data3.whicdn.com/images/48660329/tumblr_m4szi3r3Fj1r4zd5eo1_500_large.jpg |
REACCIONES DE PRECIPITACIÓN
Son aquellas reacciones originadas tras mezclar dos disoluciones y que dan como resultado un compuesto poco soluble (solo un pequeño porcentaje del soluto se disuelve en agua). Es decir, si el producto iónico de los iones del compuesto supera en un momento determinado la solubilidad, se produce una reacción de precipitación, donde los iones reaccionan rápidamente formando un sólido (el precipitado).
Ejemplo: Al mezclar una disolución de nitrato de plomo (II) y otra de yoduro potasico, ambas sales son electrolitos fuertes, por lo que se encontraran totalmente disociadas en sus iones y se producirá un precipitado de color amarillo.
 |
| http://quimicaparatodos.blogcindario.com/2009/10/00121-reacciones-de-precipitacion.html |
Ejemplo: Al mezclar una disolución de nitrato de plomo (II) y otra de yoduro potasico, ambas sales son electrolitos fuertes, por lo que se encontraran totalmente disociadas en sus iones y se producirá un precipitado de color amarillo.
Solvatación
Es el proceso mediante unas moléculas de un disolvente se unen con las moléculas o los iones de un soluto.
Ejemplo: La solvatación de un ion de sodio con agua.

http://aracelifloresg104e5.blogspot.com.es/2011_11_01_archive.html
Reacciones Exotérmicas y Endotérmicas.
En las reacciones químicas se produce siempre un intercambio de energía, normalmente suele ser mediante calor.
Las reacciones exotérmicas son las que al producirse la reacción liberan energía, a diferencias de estas, las reacciones endotérmicas son las que absorben energía para producirse.
Un ejemplo de la primera sería la formación del agua (H2+O2-->H2O+Calor), y por su parte, la segunda la formación del óxido de cromo ((NH4)2Cr2O7 + Energía → N2 + 4H2O + Cr2O3)
Las reacciones exotérmicas son las que al producirse la reacción liberan energía, a diferencias de estas, las reacciones endotérmicas son las que absorben energía para producirse.
 |
| http://neetescuela.com/reacciones-exotermicas-y-endotermicas/ |
Un ejemplo de la primera sería la formación del agua (H2+O2-->H2O+Calor), y por su parte, la segunda la formación del óxido de cromo ((NH4)2Cr2O7 + Energía → N2 + 4H2O + Cr2O3)
Ionización
Es el fenómeno físico o químico mediante el cual se producen iones, y estos iones son átomos o moléculas cargadas con electricidad debido a la falta o al exceso de electrones en relación con un átomo o molécula neutra (sin carga negativa ni positiva).
Ejemplo: Aquí se produce una ionización con todo tipo de elementos, y los que se sitúan arriba son los neutrales.
http://www.textoscientificos.com/quimica/inorganica/energia-ionizacion
Masa Molar
Ley de la conservación de la masa
Esprectografo de masas
PUNTOS DE FUSION Y EBULLICIÓN
Teoría
En esta materia se utiliza mucho la palabra "Teoría", ya sean ejemplos como la teoría de la relatividad, del caos, big ban, evolución, seguido de un largo etcétera...
Pues una teoría no es ni más ni menos que un conjunto de leyes o principios que han sido demostrados a partir de postulados o hipótesis, previamente formuladas y finalmente justificadas mediante ejemplos y afirmaciones.
Pues una teoría no es ni más ni menos que un conjunto de leyes o principios que han sido demostrados a partir de postulados o hipótesis, previamente formuladas y finalmente justificadas mediante ejemplos y afirmaciones.
 |
| http://es.slideshare.net/yinapaolamelo/teoria-cuantitativa-1970-hoy |
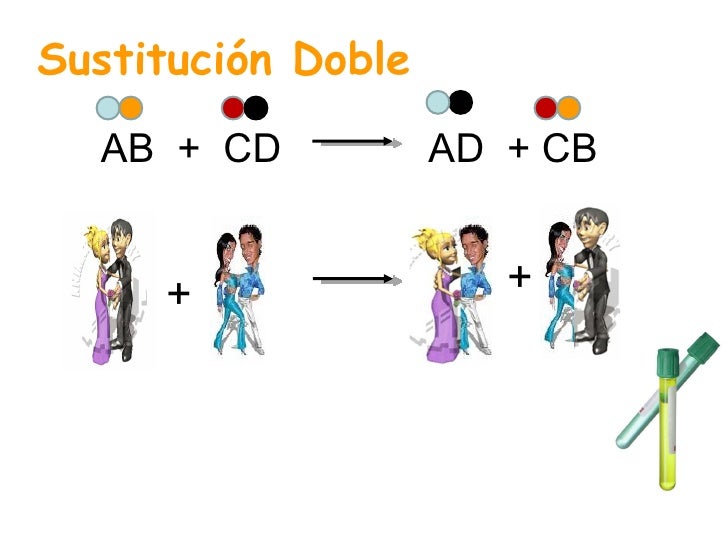
Reacciones de doble sustitución
Son aquellas reacciones en las que dos elementos que se encuentran en compuestos diferentes, intercambian posiciones formando nuevos compuesto. Son reacciones en las que no se produce una oxidación, por lo que no son reacciones REDOX:
Con el siguiente ejemplo queda muy sencillo:
Con el siguiente ejemplo queda muy sencillo:
 |
| https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjTsqQQmoVALfqNQCslBeFKGitQSdU622GAYo2sy8eVoTvYmpb7cn5t7ZbFf-ki6jTczvlWPt2W8dG_D7RCXpynoJDQHmiZO0pEYla47aTz8RYocx7mTnDf8ACR9yYhDGBuGENR15PhAGg/s1600/Nueva+imagen+%252875%2529.png
Aquí otro ejemplo con compuestos :
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgJhBbSo2R8iGCeFqg-91X2TCkGsiS-whij3qZRJtYMvYXtI2_XHEEHXkm7w_VJXKd_0vpjqxAPU4uQ6iDAI0vnp1uF4Vm5RndgvQEvIR7YK4Hx8VEd7fpVgfNGu3vVoyn9hJ6VL_iL880/s1600/Nueva+imagen+%252876%2529.png
En el ejemplo de arriba se muestra que el nitrato de plata reacciona con el cloruro de sodio, se produce una doble sustitución entre ellas, por lo que se origina en el producto cloruro de plata y nitrato de sodio.
|
Electrolisis
La electrolisis es un proceso por el cual se separan elementos de un compuesto mediante la utilización de la corriente eléctrica, hay dos partes, en el ánodo, donde ocurre una oxidación, y el cátodo con su respectiva reducción.
Ejemplo: El agua, aquí se separan el H2O, en gas oxigeno (O2) e hidrógeno (H2)
 |
| http://joseleal69.blogspot.com.es/2014/04/composicion-quimica-del-agua.html |
Polímero
Los polímeros son elementos formadas por una o varias unidades químicas, llamadas monómeros, que se unen en forma de cadena.
Un polímero es como si uniésemos con una cuerda y muchas piedras con un agujero en la parte central, tendríamos una cadena de piedras, en donde las piedras mencionadas serían los monómeros y la cadena sería el polímero.
Por ejemplo el monómero del polietileno es el etileno, el cual se repite x veces a lo largo de toda la cadena.
Polietileno = etileno-etileno-etileno-etileno-etileno-……
Un polímero es como si uniésemos con una cuerda y muchas piedras con un agujero en la parte central, tendríamos una cadena de piedras, en donde las piedras mencionadas serían los monómeros y la cadena sería el polímero.
Por ejemplo el monómero del polietileno es el etileno, el cual se repite x veces a lo largo de toda la cadena.
Polietileno = etileno-etileno-etileno-etileno-etileno-……
 |
| http://www.losadhesivos.com/definicion-de-polimero.html |
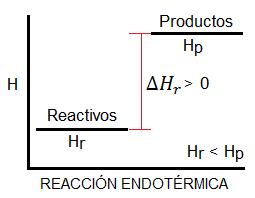
Entalpía
La entalpía de una reacción es una magnitud de termodinámica que nos informa de la cantidad de energía intercambiada en una reacción química, ya sea liberada o utilizada. La representamos con la letra H, y su comprensión es muy simple si nos ayudamos de una gráfica como la siguiente:
Pipeta
Las hay con graduaciones de diferentes volúmenes.
Unidad
Es un valor numérico que adquieren las magnitudes.
Un ejemplo: si decimos que la estatura de una persona es de 1'78 m, estamos diciendo que mide 1'78 veces más que la unidad "metro"
Un ejemplo: si decimos que la estatura de una persona es de 1'78 m, estamos diciendo que mide 1'78 veces más que la unidad "metro"
 |
| http://www.ikonet.com/es/diccionariovisual/ciencia/simbolos-cientificos/sistema-internacional-de-unidades-de-medida-2.php |
Magnitud
Por ejemplo, el peso es una magnitud, que a su vez está determinada por una unidad.
 |
| http://museovirtual.csic.es/medida/imagenes/instrumental.jpg |
Reacción de sustitución
Fracción molar
Es una unidad química utilizada para expresar la concentración de soluto en disolvente. Expresa la proporción de moles de soluto respecto a moles de disolución.
 |
| http://genesis.uag.mx/edmedia/material/quimicaII/images/Sistemas%20dispersos_clip_image020_0000.jpg |
Sistema Aislado
Reacción endotérmica
Es aquella
reacción en la que se necesita un aporte energético, es decir, que absorbe
energía. Los reactivos tienen menor
contenido energético que los productos.
La entalpía de estas reacciones es
positiva
 |
Ejemplo: La producción de Ozono que se da en las capas altas de la
atmósfera, debido a la reacción del oxígeno con los rayos ultravioletas
provenientes del Sol:
Reacción exotérmica
Es aquella
reacción en la que se desprende energía, ya sea luz o calor. Los reactivos
tienen más contenido energético que los productos.
La entalpía de estas reacciones es negativa.
La entalpía de estas reacciones es negativa.
 |
http://www.quimitube.com/videos/definicion-de-entalpia-de-reaccion-endotermica-y-exotermica |
Ejemplo: La reacción de la formación del agua, en la cual el hidrógeno reacciona espontáneamente con
el oxígeno, produciendo agua y desprendiendo calor:
2H2 + O2 --> 2 H2O + calor
Reacción redox
Son aquellas reacciones de tipo químico que llevan a la transferencia de electrones entre reactivos alterando el estado de oxidación. De este modo, un elemento libera electrones que otro elemento acepta.
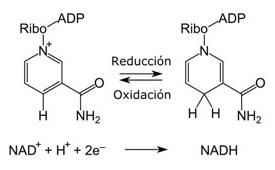 |
| https://upload.wikimedia.org/wikipedia/commons/thumb/0/04/NAD_oxidation_reduction_spanish.svg/250px-NAD_oxidation_reduction_spanish.svg.png |
Pureza
Se denomina pureza al porcentaje de la masa total que reacciona en un producto o elemento.
 |
| http://aprendeenlinea.udea.edu.co/lms/ocw/pluginfile.php/323/mod_page/content/1/Capitulo_IV/Cap4_5_Pureza_Reactivos_y_Productos/imagenes/Cap4_5_Cal_viva.jpg |
Análisis gravimetrico
La gravimetría es un método analítico cuantitativo, es decir, determina la cantidad de sustancia, midiendo el peso de la misma con una balanza analítica
 |
| https://upload.wikimedia.org/wikipedia/commons/thumb/5/59/Analytical_balance_mettler_ae-260.jpg/220px-Analytical_balance_mettler_ae-260.jpg |
Solvatacion
Sería la interacción que hay entre las partículas del soluto y disolvente al formar la disolucion
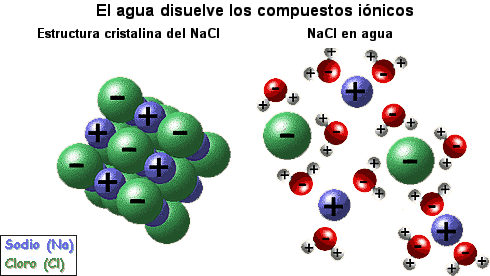 |
| http://quimicaybio.blogspot.com.es/2014/04/fuerzas-intermoleculares.html |
Disolucion concentrada y saturada
Concentrada es una disolucion en la cual el soluto se encuentra en grandes cantidades, mientras que el en la saturada es ta al limite de disoluver es decir no se puede disolver mas y se precipita
 |
| https://quimicade4to.wikispaces.com/Soluciones |
Suscribirse a:
Entradas (Atom)